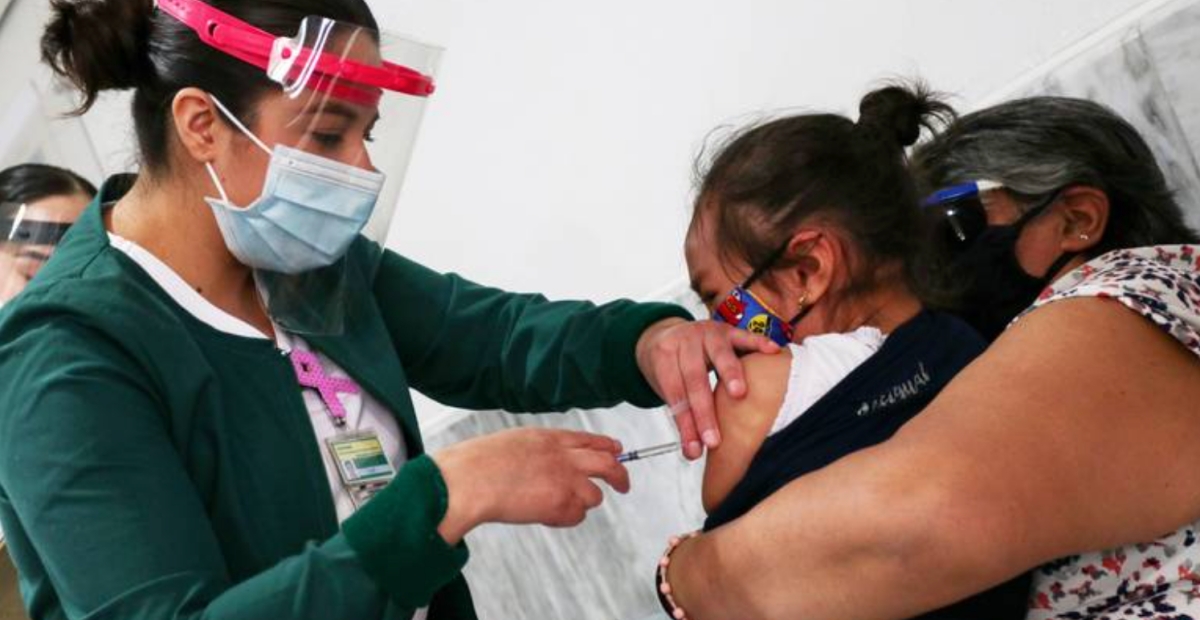
La farmacéutica estadounidense Pfizer y el laboratorio alemán BioNTech pidieron, este jueves 7 de octubre, a la Administración de Fármacos y Alimentos (FDA, por sus siglas en inglés) de Estados Unidos, la autorización para el uso de emergencia de su vacuna contra el coronavirus SARS-CoV-2 (que causa la enfermedad COVID-19), en menores de 5 a 11 años de edad.
A través su cuenta de la red social Twitter, Pfizer confirmó que realizó dicha solicitud para la autorización del fármaco. Ahora los los organismos reguladores, la FDA y los Centros de Control de Enfermedades (CDC, por sus siglas en inglés), deberán revisar la petición antes de aprobarla o rechazarla.
UPDATE: We and @BioNTech_Group officially submitted our request to @US_FDA for Emergency Use Authorization (EUA) of our #COVID19 vaccine in children 5 to <12. pic.twitter.com/72Z2HXlkOx
— Pfizer Inc. (@pfizer) October 7, 2021
Además, la FDA espera tener respuesta para la próxima semana respecto a las solicitudes de otras empresas estadounidenses, como Johnson & Johnson y Moderna, que buscan la autorización para ampliar nuevas dosis de refuerzos de sus respectivas vacunas contra la COVID-19.
Hasta el momento, la FDA solamente autoriza el uso de dicha vacuna a partir de los 12 años de edad. La pasada semana, el cirujano general de Estados Unidos, Vivek Murthy, aseguró que las vacunas para los niños entre 5 y 11 años “están ya en el horizonte”.
Janet Woodcock, comisionada interina de la FDA, dijo la semana pasada que los niños estadounidenses podrían requerir “una dosis o formulación diferente a la que se usa en una población pediátrica mayor o en adultos”.
Publicidad
El pasado 20 de septiembre, Pfizer y BioNTech dijeron que los resultados de los ensayos clínicos mostraron que su vacuna contra la COVID-19, es “segura, bien tolerada” y producía una respuesta inmune “robusta” en niños de cinco a 11 años de edad, por lo que agregaron que buscarían la aprobación regulatoria en breve.
La vacuna se administraría en una dosis más baja que para las personas mayores de 12 años de edad, según dijeron las compañías en un comunicado, en específico un tercio de la cantidad. Según Bill Gruber, vicepresidente de Pfizer, los ensayos mostraron que después de su segunda dosis, los niños de 5 a 11 años de edad desarrollaron niveles de anticuerpos que combaten el coronavirus tan fuertes como los adolescentes y los adultos jóvenes.
Asimismo, Pfizer dijo que estudió la dosis más baja en 2 mil 268 niños de jardín de infantes y niños en edad de escuela primaria. La dosis para niños también resultó segura, con efectos secundarios temporales como dolor en los brazos, fiebre o dolor, similares a los que experimentan los adolescentes.
Sin embargo, la FDA requirió lo que se llama un estudio de “puente” inmunológico, es decir, una evidencia de que los niños más pequeños desarrollaron niveles de anticuerpos que ya han demostrado ser protectores en adolescentes y adultos.
El estudio realizado por Pfizer y BioNTech aún continuaba en desarrollo, porque todavía no había suficientes casos de COVID-19 para comparar las tasas entre los vacunados y los que recibieron un placebo. Tampoco se han detectado efectos secundarios extremadamente raros, como la inflamación del corazón que a veces ocurre después de la segunda dosis, principalmente en hombres jóvenes.
Un estudio publicado, ayer miércoles 6 de octubre, por la revista especializada The Lancet, indicó que la eficacia de la vacuna de Pfizer/BioNTech para prevenir la infección por el coronavirus se redujo del 88 al 47 por ciento, seis meses después de la segunda dosis.
El mismo análisis mostró que la efectividad de la vacuna para prevenir la hospitalización y la muerte se mantuvo alta en un 90 por ciento durante al menos seis meses, incluso contra la variante Delta, la más contagiosa de todas.
LA FDA DE EU DA SU APROBACIÓN TOTAL A LA VACUNA DE PFIZER CONTRA LA COVID-19
El pasado 23 de agosto, la FDA otorgó la aprobación definitiva para el uso de la vacuna contra el coronavirus SARS-CoV-2 (que causa la enfermedad COVID-19), desarrollada por la farmacéutica estadounidense Pfizer, en conjunto con el laboratorio alemán BioNTech, en personas de 16 años edad en adelante.
La de Pfizer-BioNTech fue la primera vacuna a nivel mundial, en ser aprobada de forma total, más allá de su uso de emergencia. Esta acción permitió que su empleo se extiendiera en instituciones y organizaciones privadas de EE.UU.
“Hoy, la Administración de Drogas y Alimentos de EE.UU. Aprobó la primera vacuna COVID-19. La vacuna se conoce como la vacuna Pfizer-BioNTech Covid-19, y ahora se comercializará como Comirnaty, para la prevención de la enfermedad Covid-19 en personas de 16 años o más”, indicó la FDA, en un comunicado.
“La vacuna también sigue estando disponible bajo autorización de uso de emergencia, incluso para personas de 12 a 15 años de edad y para la administración de una tercera dosis en determinadas personas inmunodeprimidas”, agregó la FDA, cuya comisionada interina, Janet Woodcock, dijo que la aprobación de la vacuna fue “un hito a medida que continuamos luchando contra la pandemia de COVID-19″.
“Si bien esta y otras vacunas han cumplido con los rigurosos estándares científicos de la FDA para la autorización de uso de emergencia, como la primera vacuna Covid-19 aprobada por la FDA, el público puede estar muy seguro de que esta vacuna cumple con los altos estándares de seguridad, eficacia y fabricación. Calidad que la FDA requiere de un producto aprobado”, señaló el organismo gubernamental estadounidense.
“Si bien millones de personas ya han recibido vacunas COVID-19 de manera segura, reconocemos que para algunas, la aprobación de una vacuna por parte de la FDA ahora puede infundir confianza adicional para vacunarse. El hito de hoy nos acerca un paso más a alterar el curso de esta pandemia en los EE.UU.”, abundó.
“Sobre la base de los datos de seguimiento a más largo plazo que presentamos, la aprobación de hoy para los mayores de 16 años afirma la eficacia y el perfil de seguridad de nuestra vacuna en un momento en que se necesita con urgencia”, dijo, por su parte, Albert Bourla, presidente y director ejecutivo de Pfizer.
“Espero que esta aprobación ayude a aumentar la confianza en nuestra vacuna, ya que la vacunación sigue siendo la mejor herramienta que tenemos para ayudar a proteger vidas y lograr la inmunidad colectiva. Ya se han administrado cientos de millones de dosis de nuestra vacuna en EE.UU. desde diciembre de 2020, y esperamos continuar trabajando con el gobierno de EE.UU. para llegar a más estadounidenses”, insistió Bourla.
La aprobación completa sigue a “una evaluación increíblemente minuciosa y reflexiva de esta vacuna”, según Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA. Menos de cuatro meses después de que Pfizer solicitó la licencia, esta es la aprobación de vacuna más rápida en la historia dada por la citada agencia gubernamental de EE.UU.