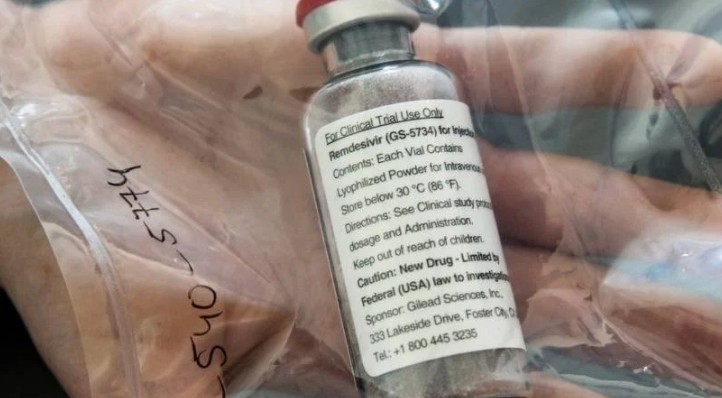
El presidente de los Estados Unidos, Donald Trump, anunció que la Agencia de Medicamentos y Alimentación de Estados Unidos (FDA, por sus siglas en inglés) autorizó este viernes 1 de mayo, el uso de emergencia del medicamento experimental Remdesivir, el cual supuestamente ha ayudado a pacientes infectados con el coronavirus SARS-CoV-2 (COVID-19), a recuperarse más rápido.
El laboratorio encargado de crear el medicamento, Gilead Sciences, Inc., anunció este este día, que el Gobierno estadounidense permitirá el uso del Remdesivir en hospitales para pacientes que necesitan un tratamiento urgente contra la COVID-19.
La compañía biofarmacéutica estadounidense aclaró que la duración óptima del tratamiento aún se está estudiando en ensayos clínicos, aunque se sugiere que dure de 5 a 10 días, según la gravedad de la enfermedad. “EE.UU nos abre el camino para proporcionar el uso de Remdesivir de emergencia a más pacientes con síntomas graves de COVID-19”, dijo Daniel O’Day, presidente y director ejecutivo de Gilead.
Los resultados preliminares del fármaco, patrocinado por Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID, por sus siglas en inglés), concluyen que el Remdesivir “acorta el tiempo de recuperación en pacientes hospitalizados con COVID-19, en comparación con un placebo”, hasta en un 31 por ciento.
Ayer, Gilead indicó que está expandiendo la fabricación de dicho fármaco, por lo que espera tener producidas unas 140 mil unidades de tratamiento hasta finales de mayo, y, en colaboración con socios internacionales, un millón para diciembre, mientras que planea “ser capaz de producir varios millones” en 2021.
“Continuaremos trabajando con socios en todo el mundo para aumentar nuestro suministro de Remdesivir, mientras avanzamos en nuestros ensayos clínicos en curso para complementar nuestra comprensión del perfil del medicamento. Estamos trabajando para satisfacer las necesidades de los pacientes, sus familias y trabajadores de la salud en todo el mundo con el mayor sentido de urgencia y responsabilidad”, indicó O’Day
Publicidad
“La acción de hoy representa un paso importante en nuestros esfuerzos para colaborar con investigadores e innovadores para proveer a pacientes de acceso a nuevas terapias cuando sea apropiado y, al mismo tiempo, apoyar próximos pasos de la investigación para continuar evaluando si son seguras y efectivas”, indicó en un comunicado, el titular de la FDA, stephen Hahn.
El Remdesivir debe administrarse por vía intravenosa, sin embargo, aún se desconoce la dosis óptima y la duración para el tratamiento contra el coronavirus, señaló en un comunicado el laboratorio biofarmacéutico. Sin embargo, la autorización permite a los médicos recetar el medicamento, a pesar de que éste aún no haya superado todas las etapas requeridas para obtener una habilitación.
“Son muy buenas noticias”, aseguró el pasado 29 de abril, Anthony Fauci, el principal infectólogo de la Casa Blanca y una de las caras visibles de los esfuerzos de la Administración encabezada por Trump contra la pandemia. “Esto es realmente bastante importante”, agregó este viernes.
El médico también dijo que los datos establecían un nuevo estándar de atención para los pacientes con el nuevo coronavirus, y se hizo eco del “claro efecto positivo en la disminución del tiempo de recuperación”, por parte de aquellos a quienes se les había administrado el antiviral.
“Lo que ha demostrado es que una droga puede bloquear este virus”, abundó Fauci, director del Instituto Nacional de Alergias y Enfermedades Infecciosas. El médico resaltó que el tiempo medio de recuperación de los pacientes que tomaban la droga era de 11 días, comparado con los 15 días del grupo con placebos.
Además, el grupo que recibió el medicamento registró una tasa de mortalidad del 8 por ciento, frente al 11.6 por ciento del que fue sometido a un placebo. No obstante, Fauci indicó que “aún no se ha alcanzado una estadística significativa” como para llegar a conclusiones a este respecto.
Desde el inicio de la pandemia la FDA emitió numerosas autorizaciones de emergencia para permitir el uso de equipos de protección, herramientas de pruebas, e incluso, ciertos respiradores que aún no habían concluido su proceso de habilitación.
El Remdesivir comenzó como un tratamiento para el ébola y el virus de Marburgo, pero también demostró utilidad contra el virus respiratorio sincitial, el de Junín, el de la fiebre de Lassa, así como para algunos coronavirus, como los causantes del síndrome respiratorio de Medio Oriente (MERS) y del síndrome respiratorio agudo grave (SARS).
Actualmente se estudia el uso de dicho fármaco contra los virus de Nipah, Hendra y el COVID-19, ya que su mecanismo consiste en interferir la replicación del microorganismo invasor. “En este momento solo hay un medicamento que creemos que puede tener una eficacia real. Y es el Remdesivir”, afirmó Bruce Aylward, de la Organización Mundial de la Salud (OMS), el mes pasado.